Istilah atom pertama kali dikemukakan oleh filsuf Yunani kuno, Demokritus (460 – 370 SM). Menurut Demokritus jika suatu materi dibelah maka pembelahan materi akan berakhir pada tingkat dimana partikel tidak dapat dibelah lagi, yang dinamakan Atom. Namun konsep atom yang dikemukakan oleh Demokritus tidak didukung oleh eksperimen yang tidak meyakinkan, sehingga tidak dapat diterima oleh beberapa ahli ilmu pengetahuan dan filsafat.
Pengembangan konsep atom-atom secara ilmiah dimulai oleh Jhon Dalton (1805), kemudian dilanjutkan oleh Thomson (1897), Rutherford (1911), dan disempurnakan oleh Bohr (1914).
Teori Atom Dalton
Berikut adalah postulat-postulat dalam teori atom Dalton.
- Setiap unsur terdiri atas partikel yang sudah tak terbagi yang dinamai atom.
- Atom-atom dari suatu unsur adalah identik. Atom-atom dari unsur yang berbeda mempunyai sifat-sifat yang berbeda, termasuk mempunyai massa yang berbeda.
- Atom dari suatu unsur tidak dapat diubah menjadi atom unsur lain, tidak dapat dimusnahkan atau diciptakan. Reaksi kimia hanya merupakan penataan ulang atom-atom.
- Senyawa terbentuk ketika atom-atom dari dua jenis unsur atau lebih bergabung dengan perbandingan tertentu.
Pada perkembangan selanjutnya diketahui bahwa beberapa postulat dalam teori atom Dalton ternyata kurang tepat, misalnya:
- Ternyata atom bukanlah sesuatu yang tak terbagi, melainkan terdiri dari berbagai partikel subatom.
- Meski mempunyai sifat-sifat yang sama, atom-atom dari unsur yang sama dapat mempunyai massa yang berbeda. Atom-atom dari unsur yang sama, tetapi mempunyai massa yang berbeda disebut isotop.
- Melalui reaksi nuklir, atom dari suatu unsur dapat diubah menjadi atom unsur lain.
- Beberapa unsur tidak terdiri atas atom-atom melainkan molekul-molekul. Molekul unsur terbentuk dari atom-atom sejenis dengan jumlah tertentu.
Meskipun demikian, Dalton telah meletakkan anak tangga pertama bagi perkembangan teori atom selanjutnya. Hal yang paling penting dari teori atom Dalton yang hingga kini dapat diterima yaitu:
- Atom adalah unit pembangun dari segala macam materi.
- Atom merupakan bagian terkecil dari suatu unsur yang masih mempunyai sifat sama dengan unsurnya.
- Dalam reaksi kimia, atom tidak dimusnahkan, tidak dicipakan, dan tidak dapat diubah menjadi atom unsur lain. Reaksi kimia hanyalah penataan ulang susunan atom-atom yang terlibat dalam reaksi.
 Gambar1. Model Atom Dalton (sumber : kimia.upi.edu)
Gambar1. Model Atom Dalton (sumber : kimia.upi.edu)
Model Atom Thomson
Setelah tahun 1897 Joseph John Thomson berhasil membuktikan dengan tabung sinar katode bahwa sinar katode adalah berkas partikel yang bermuatan negatif (berkas elektron) yang ada pada setiap materi maka tahun 1898 J.J.Thomson membuat suatu teori atom. Menurut Thomson, atom berbentuk bulat di mana muatan listrik positif yang tersebar merata dalam atom dinetralkan oleh elektron-elektron yang berada di antara muatan positif. Elektron-elektron dalam atom diumpamakan seperti butiran kismis dalam roti, maka Teori Atom Thomson juga sering dikenal Teori Atom Roti Kismis. 
Gambar 2. Model Atom Thomson (sumber : kimia.upi.edu)
Gambar 3. Percobaan Tabung Sinar Katoda (sumber : kimia.upi.edu)
Model Atom Rutherford
Pada tahun 1903 Philipp Lenard melalui percobaannya membuktikan bahwa teori atom Thomson yang menyatakan bahwa elektron tersebar merata dalam muatan positif atom adalah tidak benar. Hal ini mendorong Ernest Rutherford (1911) tertarik melanjutkan eksperimen Lenard. Dengan bantuan kedua muridnya Hans Geiger dan Ernest Marsden, Rutherford melakukan percobaan dengan hamburan sinar α. Partikel α bermuatan positif.
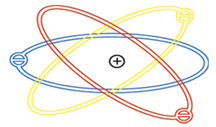
Kemudian Rutherford mengajukan teori atom sebagai berikut: atom tersusun atas inti atom yang bermuatan positif sebagai pusat massa dan dikelilingi elektron-elektron yang bermuatan negatif.
 Gambar 4.Percobaan Rutherford (sumber : kimia.upi.edu)
Gambar 4.Percobaan Rutherford (sumber : kimia.upi.edu)
Gambar 5. Model Atom Rutherford (sumber : kimia.upi.edu)
Model Atom Niels Bohr
Pada tahun 1913, berdasarkan analisis spektrum atom, Niels Bohr mengajukan model atom sebagai berikut:
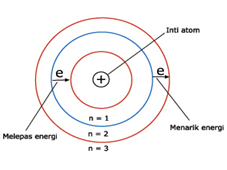
- Atom terdiri atas inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif didalam suatu lintasan.
- Elektron dapat berpindah dari satu lintasan ke yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang. Jika berpindah lintasan ke lintasan yang lebih tinggi, elektron akan menyerap energi. Jika beralih ke lintasan yang lebih rendah, elektron akan memancarkan energi.
- Kedudukan elektron-elektron pada tingkat-tingkat energi tertentu yang disebut kulit-kulit elektron.
Gambar 6. Model Atom Bohr (sumber : kimia.upi.edu)
Model Atom Modern
Pada tahun 1927, Erwin Schrodinger, mengemukakan teori atom yang disebut teori atom mekanika kuantum atau mekanika gelombang. Teori tersebut dapat diterima para ahli sampai sekarang
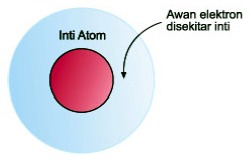
Menurut teori atom mekanika kuantum, kulit-kulit elektron bukan kedudukan yang pasti dari suatu elektron, tetapi hanyalah suatu kebolehjadian saja.
Gambar 7. Mekanika Kuantum (sumber : kimia.upi.edu)
Handout Materi
|
No. |
Model Atom |
Keterangan |
| 1. | Dalton (1803) | Atom menurut Dalton:a. Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi
b.Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang lainnya c. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atas atom-atom hidrogen dan atom-atom oksigen d.Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan. Kelebihan :
Kelemahan :
|
| 2. | Thomson (1910) | Berdasarkan percobaan sinar katoda, atom menurut Thomson :Suatu materi berbentuk bola bermuatan positif, dan didalamnya tersebar elektron-elektron dengan jumlah muatan positif dan negatif sama sehingga membentuk atom yang bersifat netral
Kelebihan :
Kelemahan : Tidak dapat menerangkan bagaimana susunan muatan positif dan negatif dalam bola atom tersebut |
| 3. | Rutherford (1913) | Berdasarkan penembakan lempeng tipis dengan partikel alpha, atom menurut Rutherford :Atom terdiri dari inti atom yang bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti atom, dimana massa atom terpusat pada inti atomnya
Kelebihan : Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika klasik, gerakan elektron mengelilingi inti ini disertai pemancaran energi sehingga lama-kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh kedalam inti |
| 4. | Bohr | Berdasarkan pengamatan spektrum garis atom hidrogen, ato menurut Bohr :
Kelebihan : Mampu membuktikan adanya lintasan elektron untuk atom hidrogen Kelemahan : Tidak dapat menjelaskan spektrum warna dari atom-atom yang memiliki banyak elektron |
| 5. | Teori Atom Modern | Dikembangkan berdasarkan teori mekanika kuantum yang disebut mekanika gelombang; diprakarsai oleh 3 ahli :a) Louis Victor de Broglie : menyatakan bahwa materi mempunyai dualisme sifat yaitu sebagai materi dan sebagaigelombang.
b) Werner Heisenberg : mengemukakan prinsip ketidakpastian untuk materi yang bersifat sebagai partikel dan gelombang. Jarak atau letak elektron-elektron yang mengelilingi inti hanya dapat ditentukan dengan kemungkinan – kemungkinan saja. c) Erwin Schrodinger (menyempurnakan model Atom Bohr): Berhasil menyusun persamaan gelombang untuk elektron dengan menggunakan prinsip mekanika gelombang. Elektron-elektron yang mengelilingi inti terdapat di dalam suatu orbital yaitu daerah 3 dimensi di sekitar inti dimana elektron dengan energi tertentu dapat ditemukan dengan kemungkinan terbesar. Model atom Modern : a) Atom terdiri dari inti atom yang mengandung proton dan neutron sedangkan elektron-elektron bergerak mengitari inti atom dan berada pada orbital-orbital tertentu yang membentuk kulit atom. b) Orbital yaitu daerah 3 dimensi di sekitar inti dimana elektron dengan energi tertentu dapat ditemukan dengan kemungkinan terbesar. c) Kedudukan elektron pada orbital-orbitalnya dinyatakan dengan bilangan kuantum. |
Penjelasan Atom dalam Al-Quran
| Atom juga ternyata dibahas dalam Al-Quran surat Saba ayat 3 yang artinya:Dan orang-orang yang kafir berkata, “Hari Kiamat itu tidak akan datang kepada kami”.Katakanlah, “Pasti datang, demi Tuhanku yang mengethui yang ghaib, Kiamat itu pasti akan datang kepadamu. Tidak ada yang tersembunyi bagiNya sekalipun seberat zarrah1 baik yang dilangit maupun yang di bumi, yang lebih kecil dari itu atau yang lebih besar, semuanya tertulis dalam kitab yang jelas (Lauh Mahfuz),”
Penjelasan: Zarrah adalah jenis yang terkecil dari semut. Orang Arab mengungkapkan sesuatu yang paling kecil dengan sebutan Zarrah. |


Tinggalkan komentar